フェロトーシス(Ferroptosis)について
鉄イオンを多く含むがん細胞はフェロトーシスを起こしやすい
注:このサイトの記事は「フェロトーシス(Ferroptosis)」に関して医学論文に報告されている内容をまとめたものです。何らかの治療薬を宣伝・広告するものではあリません。
【がん細胞は鉄を多く取込んでいる】
私たちの体内には、体重60kgで平均4g程度(2〜6gくらい)の鉄が存在します。鉄は全て食事から体内に摂取しています。
鉄は酸素などの小さな分子と強く特異的に結合する性質があります。体内の鉄の60%くらいはヘモグロビンのヘムとして存在し、酸素を運搬する働きを担っています。
鉄はイオンの価数が変化する遷移金属で、簡単に二価イオン(ferrous:Fe2+)と三価イオン(ferric : Fe3+)の両方の型を行き来するので、電子の移動を伴う生体反応に利用できます。
例えば、NADPHオキシダーゼ、キサンチンオキシダーゼ、リポキシゲナーゼ、チトクロームP450酵素など、活性酸素を産生させるような酵素の活性に必要です。
ATPを生産するミトコンドリアの電子伝達系のタンパク質など電子を輸送する様々なタンパク質にも使われています。ペルオキシソームで過酸化水素(H2O2)を分解するカタラーゼの活性にも鉄が必須です。
このように、鉄イオンは細胞の呼吸、核酸合成、増殖などに必須な補助因子として重要な役割を果たしています。
血液中では鉄イオンはトランスフェリンに結合して細胞まで運ばれます。
1つのトランスフェリンに2つの3価鉄(Fe3+)が結合します。 トランスフェリンは細胞膜にあるトランスフェリン受容体と結合し,エンドサイトーシスによって取り込まれ、リソソーム内で酸性の環境になると鉄イオンが解離し、2価の鉄(Fe2+)になって細胞内に取り込まれます。
フリーの2価鉄イオンは鉄の利用の主要な器官であるミトコンドリアへの供給に必要な細胞質鉄プール(酸化還元活性のある不安定鉄プール)として蓄積され、DNA合成、細胞周期の制御、ミトコンドリアでのATP産生などに必須の働きを担っています。
利用されない細胞質鉄プールのFe2+は、鉄を介した細胞の損傷を防ぐためフェリチンと結合して酸化還元反応を起こさない三価鉄(Fe3+)として貯蔵されるか、あるいは、フェロポーチンにより細胞外に排出されます。
フェリチンは体内で鉄を貯蔵するタンパク質で、鉄とアポフェリチンによって構成され、多くの鉄イオンの周りをミセルで覆うことによって鉄を貯蔵します。(下図)
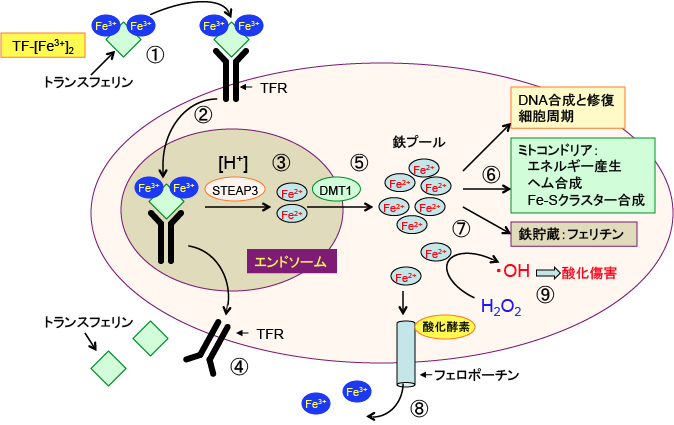
図:① 鉄はトランスフェリンに結合して全身を循環している。1分子のトランスフェリンは3価の鉄イオン(Fe3+)を2個運搬できる。② 細胞膜に存在するトランスフェリン受容体に3価鉄イオンを結合したトランスフェリンが結合すると、この複合体はエンドサイトーシスによって細胞内に取り込まれる。③ エンドソーム内の酸性の環境では、鉄イオンはトランスフェリンから離れ、3価の鉄イオン(Fe3+)は2価の鉄イオン(Fe2+)に還元される。④ 鉄が離れたトランスフェリンとトランスフェリン受容体は細胞膜に戻り、再利用される。⑤ 2価の鉄イオンは2価金属トランスポーター1(DMT1)を通ってエンドソームを出て細胞質に移行し、細胞内の様々な機能に使用される不安定鉄プール(the labile iron pool)に入る。⑥ 鉄イオンは細胞内の様々な目的で使用される。例えば、DNA合成に必要な酵素(リボヌクレオチド還元酵素など)の補因子、ヘム合成、鉄-イオウクラスターの形成など。⑦ 余剰の鉄イオンは鉄貯蔵タンパク質のフェリチンの中に貯蔵される。⑧ 鉄イオンは鉄排出ポンプであるフェロポーチンによって細胞外に排出される。⑨ 細胞質の2価鉄イオンは過酸化水素(H2O2)と反応して酸化作用の強いヒドロキシラジカル(・OH)を発生させ、細胞傷害を引き起こすので、細胞内での鉄イオンの利用は貯蔵や排出の調節が重要となる。
【2価鉄イオンは発がんを促進する】
鉄は様々な生体反応に必須の物質ですが、過剰になると活性酸素発生の触媒作用を発揮することによって発がんのリスクを上げることが明らかになっています。 鉄の代謝異常で細胞内に鉄が多く蓄積する遺伝性疾患や、慢性炎症などでフリーの鉄イオンが増える状況では、細胞のがん化が促進することが明らかになっています。
さらに、人間では定期的に除鉄を行うとがん発生が抑制されることが明らかになっています。 1年に2回の定期的瀉血が内臓がんの発生を35%減少させるという論文が2008年に報告されています。(J Natl Cancer Inst. 2008 Jul 16;100(14):996-1002.)
つまり、献血のようにして定期的に瀉血して、体内の過剰な鉄を減らすことはがん予防に有効であることが示されています。
さらに、鉄による酸化傷害を防ぐことは細胞の老化の抑制にも有効です。
2価のフリーの鉄は過酸化水素(H2O2)と反応してより有毒なヒドロキシラジカルを生じ(フェントン反応)、DNA障害、脂質酸化、アポトーシスなどを引き起こします。
鉄は電子の授受を容易に行いうることから種々の酵素の活性中心として働いており,地球上のほぼすべての生物にとりその生存に必須な元素です。 しかし一方で,二価鉄(Fe2+)が過剰に存在すると,その高い反応性ゆえにフリーラジカルの産生を促進し細胞に対する傷害性をもたらすということです。
つまり、鉄は「両刃の剣」であり、鉄は不足しても過剰でも生体に悪影響を及ぼすため、生体においては鉄の量がつねに適切な量になるよう厳密に調節される必要があるのです。(下図)。
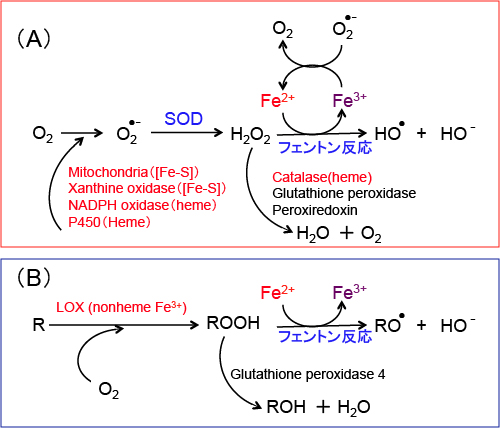
図:フェントン反応による過酸化水素(H2O2)からのヒドロキシラジカル(HO・)の産生(A)と脂質(ROOH)からの脂質ラジカル(RO・)の産生経路。鉄イオンが関与する酵素は赤で示している。
慢性炎症組織やがん組織では、この鉄イオンの調節に破綻をきたし、フリーの2価鉄が過剰に存在する状況になっています。この過剰鉄がフリーラジカルや活性酸素の産生を惹起して細胞毒として働き、細胞のがん化や進展を促進すると考えられています。
したがって、慢性炎症やがんの予防や治療における戦略としては、鉄イオンを減らす方法が考えられます。この方法として、瀉血や鉄のキレート剤の使用があります。このような方法で鉄を減らせば、慢性炎症やがんの発生や進行を抑えられると考えられています。
しかし一方、がん細胞内に過剰な2価鉄イオンが存在することを利用して、がん細胞を死滅させる治療が検討されています。 鉄が関与するフェロトーシス(ferroprosis)という細胞死の存在とメカニズムが明らかになってきたからです。
【がん抑制遺伝子p53はフェロトーシスを誘導する】
細胞死のメカニズムとして,アポトーシス,ネクローシス,オートファジーなどが知られています。
アポトーシス(Apoptosis)は正常細胞が老化して新しい細胞に置き換わるような、生体の細胞回転で使われる細胞死のパターンです。生体では1日に約200分の1の細胞がアポトーシスで死滅し、再生した新しい細胞が補っています。この様な細胞交代型の細胞死では、免疫細胞や炎症細胞が気づかないような死に方をします。このような生理的な細胞交代型の細胞死に炎症反応が惹起されると生体は大変なことになるからです。
一方、脳梗塞や心筋梗塞の用な虚血や、火傷や毒物による細胞傷害では、壊死(ネクローシス:Necrosis)という細胞死を起こして、細胞が崩壊して炎症反応が引き起こされます。炎症反応を引き起こすことによって、生体に異常事態を知らせ、防御や修復を促進することができます。
オートファジー(autophagy)は細胞内の構成成分を分解するための細胞機能で、このオートファジーが関与するプログラム細胞死をオートファジー細胞死と呼んでいます。
このように細胞はいろんなメカニズムや方法で死滅します。細胞死のメカニズムはこの3つだけではありません。 最近、フェロトーシス(Ferroptosis)という細胞死が提唱されています。
フェロトーシスは,細胞死の1つの機構と考えられていますが,アポトーシスやネクローシスやオートファジーの3つの細胞死とは異なる特徴を有します。 フェロトーシスでは,鉄依存的な活性酸素種の発生と過酸化した脂質の蓄積によって,細胞死が起こります。 細胞内の鉄に依存する機構であり,ほかの金属類には依存しません。「フェロ(Ferro)」は「鉄」という意味です。
フェロトーシス(Ferroptosis)という言葉は2012年のCellの論文で初めて提唱されています。Ferroptosis: an iron-dependent form of nonapoptotic cell death.(フェロトーシス:鉄依存性の非アポトーシス性の細胞死)Cell. 2012 May 25;149(5):1060-72.
Cellは細胞生物系ではトップレベルの学術雑誌ですので、フェロトーシスという細胞死の存在が認められたと言えます。 さらにNatureにも報告があります。以下のような論文があります。
Ferroptosis as a p53-mediated activity during tumour suppression.(p53介在性の腫瘍抑制の作用機序としてのフェロトーシス)Nature. 2015 Apr 2;520(7545):57-62.
【要旨】
p53介在性の細胞周期停止や老化やアポトーシスは発がん過程における重要ながん抑制メカニズムであるが、細胞の代謝におよぼすp53の活性も発がん抑制のメカニズムに重要である。 この研究では、p53がシスチン/グルタミン酸交換輸送体(cystine/glutamate antiporter)の主要な構成タンパク質であるSLC7A11の発現を抑制して、シスチンの細胞内取り込みを阻害することによって、非アポトーシス性の細胞死のフェロトーシスを誘導することを明らかにした。
重要なことは、アセチル化ができない変異型p53は細胞周期停止や細胞老化やアポトーシス誘導ができないが、SLC7A11発現の抑制や、活性酸素種の産生亢進による酸化ストレス亢進によるフェロトーシスの誘導作用は保持されていた。 変異p53を持つマウスの解析で、このような非定型的なp53活性は、胚発生過程で重要な働きを担い、Mdm2欠損による胚致死性と関連していた。
さらに、SLC7A11はヒトのがん細胞で発現が高度に亢進しており、このSLC7A11の過剰発現は活性酸素誘導性のフェロトーシスを阻害し、移植腫瘍の実験モデルにおけるp53介在性の腫瘍増殖抑制作用を阻止した。 これらの研究結果は、p53がシスチンの代謝と活性酸素種に対する応答とフェロトーシスの制御に作用して、抗腫瘍作用を示す新規のメカニズムを明らかにしている。シスチンは細胞内のグルタチオンの合成に必要です。したがって、シスチンの取込みを阻害すると抗酸化力が低下して活性酸素の産生が亢進すると細胞は死にやすくなります。
Mdm2はp53の活性を抑制的に制御する遺伝子です。Mdm2はユビキチンリガーゼでp53をプロテオソーム依存性の分解に導きます。
がん細胞ではMdm2の発現が亢進してp53の活性が低下してがん細胞の増殖が亢進している場合も多くあります。 このMdm2遺伝子の欠損はp53の活性亢進によって胚発生段階で死をきたします。このMdm2欠損による胚致死性にp53によるフェロトーシス誘導が関与しているという結果です。
p53遺伝子はヒトのがんの約半数で異常を認める最も代表的ながん抑制遺伝子です。p53は細胞周期、細胞老化、細胞死、オートファジーなどに関与する遺伝子群の発現を制御する転写因子で、この転写因子としての機能が発がん抑制のメカニズムになっています。
この論文の内容の重要性は、Natureに掲載されているということで理解できます。
簡単にまとめると、「p53はシスチン/グルタミン酸交換輸送体(シスチン・トランスポーター)の働きを抑制して、酸化ストレスに対する抵抗性を減弱させ、フェロトーシスという鉄介在性の細胞死を起こしやすくする」ということです。
シスチン/グルタミン酸交換輸送体の働きを抑制してシスチンの細胞内取り込みを阻害するとグルタチオンの産生が低下して抗酸化力が減弱して酸化ストレスに対する抵抗性が低下します。
シスチンの細胞内取り込みを阻止する薬としてスルファサラジンが有名です。
フェロトーシスを誘導する方法としてアルテスネイトがあります。 さらに、がん細胞に酸化ストレスを高める方法としてミトコンドリアを活性化するジクロロ酢酸ナトリウムや、ミトコンドリアの活性酸素の産生を高めるメトホルミン、解糖系を阻害する2-デオキシ-D-グルコース、ケトン食などがあります。
「フェロトーシスをターゲットにしたがん治療法」を理解すると、新しいがん治療が実践できるかもしれません。 そのためには、シスチン/グルタミン酸交換輸送体や酸化ストレスなどについて理解する必要があります。
【細胞内のグルタチオンの濃度が減少すると酸化ストレスで死にやすくなる】
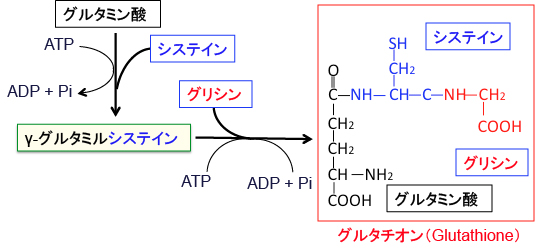
グルタチオン(Glutathione)は、グルタミン酸とシステインとグリシンの3つのアミノ酸が結合したトリペプチドです。 γ-グルタミルシステイン合成酵素によってグルタミン酸とシステインが結合してγ-グルタミルシステインを合成し、引き続いてグルタチオン合成酵素によってγ-グルタミルシステインにグリシンが結合してグルタチオンが合成されます。
図:グルタチオンは3つのアミノ酸(グルタミン酸、システイン、グリシン)が結合して合成される。
グルタチオンは細胞内に0.5~10mMという非常に高濃度で存在します。チオール基(SH基)を持ち、この水素が電子を供与することによって活性酸素やフリーラジカルを消去します。
還元型のグルタチオンはGSH(Glutathione-SH)と表記され、GSHが活性酸素などで酸化されると酸化型グルタチオンGSSG(Glutathione-S-S-Glutathione)になります。
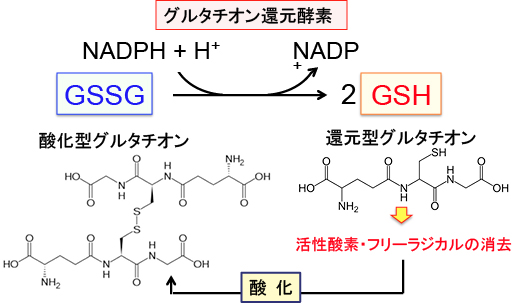
つまり、酸化型は、二分子の還元型グルタチオンがジスルフィド結合(2個のイオウ原子が繋がった状態)によってつながった分子です。 細胞内で発生した活性酸素やフリーラジカルに電子を与えて酸化型になったグルタチオンを還元型に戻す酵素がグルタチオンレダクターゼ(グルタチオン還元酵素)で、このときNADPH(ニコチンアミドアデニンジヌクレオチドリン酸、nicotinamide adenine dinucleotide phosphate)から水素をもらいます。
図:還元型グルタチオンは活性酸素(スーパーオキサイド、過酸化水素など)などと反応して酸化され、2量体化した酸化型グルタチオン(GSSG)に変化するが、グルタチオン還元酵素がNADPHからの電子をGSSGに転移して、GSH(還元型グルタチオン)に再生される。
グルタチオンの合成にはATPが必要です。 つまり、グルタミン酸やシステインやグリシンが不足したり、ATPが十分に産生できなかったり、γ-グルタミルシステイン合成酵素やグルタチオン合成酵素の活性が阻害されれば、グルタチオンの濃度は低下して、酸化ストレスに対する抵抗力が低下することになります。
さらに酸化型グルタチオンを還元するNADPHはグルコース代謝のペントース・リン酸経路で産生されます。
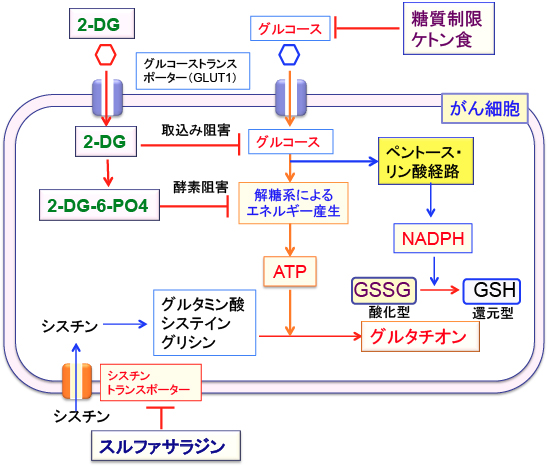
つまり、がん細胞のグルコース取り込みや解糖系やペントース・リン酸経路を阻害するケトン食や2−デオキシ-D-グルコースはNHDPHの供給を減らすことによって、グルタチオンの合成を低下させ、酸化ストレスに対する抵抗性を減弱させることができます。 ケトン食や2−デオキシ-D-グルコースでがん細胞のグルコース代謝(解糖系とペントースリン酸経路)を低下させればATPとNADPHの産生が低下します。
図:2-デオキシ-D-グルコース(2-GD)と糖質制限やケトン食はがん細胞のグルコース取込みや代謝を阻害してATPとNADPHの産生を阻害する。ATPとNADPHの量が減ると、グルタチオンの合成や酸化型から還元型への変換ができなくなって、がん細胞は酸化ストレスに対して抵抗性が低下する。スルファサラジンはシスチン・トランスポータの働きを阻害してグルタチオンの合成を阻害する。
【スルファサラジンはがん細胞のグルタチオン濃度を低下させて死にやすくする】
がん細胞が抗がん剤などで死ににくい理由の一つとして、グルタチオンの関与が指摘されています。
がん細胞は還元型グルタチオン(GSH)の合成を促進することで、酸化ストレス抵抗性を高め、増殖や転移や治療抵抗性を高めていることが知られています。
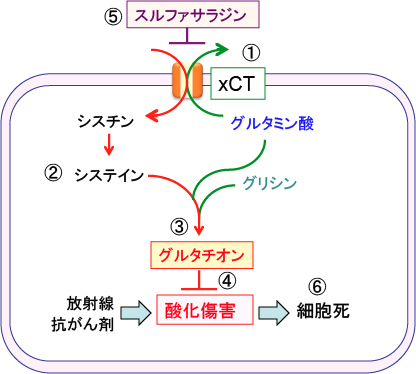
シスチン・トランスポーター(xCT)はシスチン/グルタミン酸交換輸送体とも呼ばれ、哺乳類細胞形質膜上に発現するアミノ酸トランスポーターの一種で、細胞内のグルタミン酸との交換により細胞外のシスチンを細胞内に輸送する機能を有します。
シスチンはグルタチオンの構成成分であるシステインが2個結合したアミノ酸で、シスチンが細胞内に取り込まれると、システインに代わってグルタチオンを合成する材料になるというわけです。
このトランスポーターの発現が亢進すると、細胞内グルタチオンレベルが上昇し、これによって、活性酸素などの酸化ストレスに対する防御能が高まると考えられます。
スルファサラジン(別名:サラゾスルファピリジン:商品名はサラゾピリンなど)という潰瘍性大腸炎の治療に使われている既存薬にシスチン・トランスポーターを特異的に阻害する作用があることが報告されています。
シスチントランスポーターの阻害剤であるスルファサラジンを投与すれば、がん細胞内のグルタチオンの濃度が低下し、酸化ストレスに対する抵抗性が低下するので、抗がん剤や放射線治療が効きやすくなると推測されます。そこでそのような臨床試験が始まっているということです。
シスチントランスポーターの阻害以外にも、グルタチオン合成に関与する酵素の阻害剤なども臨床試験が行われています。 グルタチオンの生合成や酸化型から還元型のグルタチオンに再生するメカニズムの複数の作用点を同時に阻害すれば、より効率的にグルタチオンの濃度を低下させることができます。 そのような方法としてがん細胞のグルコース代謝を阻害するケトン食や2-デオキシ-D-グルコースの有効性も指摘されています。
図:①シスチン/グルタミン酸交換輸送体(xCT) は、シスチンとグルタミン酸を輸送基質とする交換輸送体で、細胞内のグルタミン酸を放出し、細胞外のシスチンを取り込む。②シスチンはシステイン2分子がS-S結合したアミノ酸で、細胞内でシステインに還元される。③システインはグルタミン酸とグリシンと結合してグルタチオンが合成される。④グルタチオンは酸化ストレスを軽減することによって抗がん剤や放射線治療に抵抗性を与える。⑤xCTの働きを阻害する作用のあるスルファサラジンは、細胞内のシステインを減らしてグルタチオンの濃度を低下させ、⑥その結果、がん細胞の酸化ストレス抵抗性を減弱することによって細胞死を亢進する。
【アルテスネイトはフェロトーシス(Ferroptosis)を誘導する】
アルテスネイトはマラリアの特効薬で、これを開発した中国の女性科学者の屠呦呦(Tu Youyou)博士は2015年度のノーベル医学生理学賞を受賞しています。(詳しくはこちらへ)
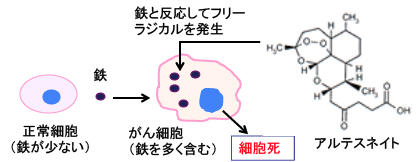
アルテスネイトは分子の中に鉄イオンと反応してフリーラジカルを産生するendoperoxide bridge を持っており、がん細胞は鉄を多く取り込んでいるので、その鉄と反応してフリーラジカルを産生してがん細胞を死滅させるという作用機序が提唱されています。つまり鉄介在性の細胞死です(下図)。
このアルテスネイトによる鉄介在性の細胞死は1990年代から知られており、がん治療の目的でアルテスネイトを服用する数時間前に鉄剤を服用してがん細胞に鉄を多く取込ませておくと、抗腫瘍効果を高めることができます。
図:アルテスネイトは鉄イオンと反応してフリーラジカルを産生するendoperoxide bridge を持っている。がん細胞は正常細胞に比べて鉄を多く含むので、がん細胞を選択的に傷害することができる。
がん細胞で活性が亢進している転写因子の低酸素誘導性因子-1(HIF-1)はトランスフェリン受容体の発現を高めます。 前述のように、トランスフェリンは鉄イオンを結合して運搬するタンパク質で、トランスフェリン受容体はトランスフェリンと鉄を細胞内に取り込む受容体です。
鉄は細胞増殖に必要なため、がん細胞はトランスフェリン受容体を多く発現して鉄を多く取り込んでいます。細胞分裂の早いがん細胞ほど鉄を多く取り込んでいると言われています。
したがって、がん細胞内の鉄と反応してフリーラジカルを発生するアルテスネイトは、正常細胞を傷つけずにがん細胞に選択的に傷害を与えることができます。
がん細胞内でフリーラジカルを産生して酸化ストレスを高める以外に、血管新生阻害作用、DNAトポイソメラーゼIIa阻害作用、細胞増殖や細胞死のシグナル伝達系に影響する作用なども報告されています。 最近の報告ではアルテスネイトがフェロトーシス(Ferroptosis)を誘導することが注目されています。 以下のような論文が報告されています。Artemisinin derivatives induce iron-dependent cell death (ferroptosis) in tumor cells. (アルテミシニン誘導体は腫瘍細胞に鉄依存性細胞死(フェロトーシス)を誘導する)Phytomedicine. 2015 Oct 15;22(11):1045-54.
【要旨】
研究の背景:抗がん作用のある合成成分や天然物の作用機序を解明する目的で、アポトーシスやその他の種類の細胞死のメカニズムが研究されている。最近、細胞死の新しいメカニズムとして「フェロトーシス(ferroptosis)」と呼ばれる細胞内の鉄に依存した細胞死が注目されている。本研究では、10種類のアルテミシニン誘導体の細胞傷害活性における細胞内の鉄の代謝と恒常性に関わる遺伝子の役割を系統的に検討した。
材料と方法:10種類のアルテミシニン誘導体(artesunate, artemether, arteether, artenimol, artemisitene, arteanuin B, another monomeric artemisinin derivative and three artemisinin dimer molecules)の60種類のがん細胞株に対する50%増殖阻害濃度(IC50)を検討した。それぞれの細胞株の鉄代謝関連の30種類の遺伝子の発現量を検討した。 鉄のキレート剤のdesferoxamineやフェロトーシスの阻害剤のferrostatin-1による影響を検討した。トランスフェリン受容体タンパク質の発現量は免疫染色法で評価した。
結果:トランスフェリン、トランスフェリン受容体1と2、セルロプラスミン、ラクトフェリンなど鉄代謝関連の遺伝子の発現量は、アルテミシンの細胞傷害活性と相関していた。フェロトーシス阻害剤のferrostatin-1と鉄のキレーター(結合して働きを阻害する物質)のdeferoxamineはアルテミシニン誘導体によるがん細胞死を阻害した。これらの結果は、アルテミシン誘導体によるがん細胞の細胞死にフェロトーシスのメカニズムが関与していることを示唆している。
結論:鉄代謝に関連する遺伝子の発現量が多いがん細胞ほど、アルテミシニン誘導体による細胞死が起こりやすい。アルテミシニン誘導体はがん細胞にフェロトーシスを誘導する作用を持ち、がん治療への応用が期待される。 がん細胞の鉄関連の遺伝子の発現量を検査することは、アルテミシニン誘導体の治療効果の予測に役立つ。アルテミシニン誘導体によるフェロトーシスの誘導は、がん治療としてさらに検討する必要がある。次のような報告もあります。
Identification of artesunate as a specific activator of ferroptosis in pancreatic cancer cells.(膵臓がん細胞におけるフェロトーシスの選択的活性剤としてのアルテスネイトの同定)Oncoscience. 2015 May 2;2(5):517-32. eCollection 2015.
【要旨】
がん遺伝子のKRasの活性化は、膵臓がん細胞のアポトーシス抵抗性を高める。したがって、膵臓がん細胞の細胞死を誘導する治療が重要である。
アルテスネイトは抗マラリア薬として使用されているが、様々な種類のがん細胞にプログラム細胞死を誘導することが報告されている。アルテスネイトはがん細胞内で活性酸素種の産生を高めることによって細胞死を誘導する作用メカニズムが示されている。
本研究では、アルテスネイトが膵臓がん細胞において活性酸素種とリソゾームの鉄に依存するメカニズムで細胞死を誘導することを明らかにした。 KRasを恒常的に発現している膵臓がん細胞において、アルテスネイトは強い細胞傷害活性を示した。アルテスネイトは非腫瘍性の膵管上皮細胞に対しては細胞傷害作用を示さなかった。
アルテスネイトによる細胞死はアポトーシスでも壊死(ネクローシス)でもなく、フェロトーシス(ferroptosis)であった。
ファロトーシスは最近になって明らかになった細胞死のメカニズムで、活性酸素種や鉄に依存するプログラムされたネクローシス(壊死)の一種で、特にRasが活性化した細胞で引き起こされることが知られている。
アルテスネイトを添加した培養液にフェロトーシス阻害剤のferrostatin-1を添加すると、アルテスネイトで誘導される脂質過酸化と細胞死が阻止され、細胞は長期間生存し増殖した。
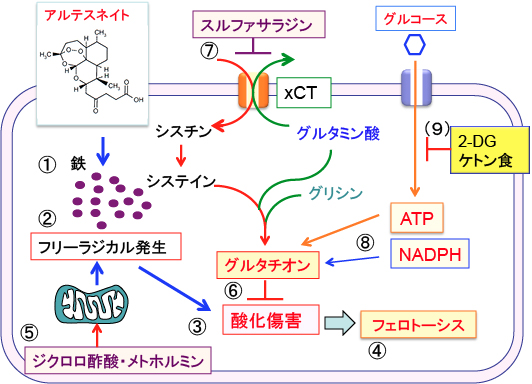
アルテスネイトによるフェロトーシスの活性化は膵臓がんの治療法として新規で有効な治療法となる可能性がある。フェロトーシスをがん細胞に効率的に誘導する方法として以下のような治療法が可能です。
1. 朝か昼の食後に鉄剤(フェロミアなど)を服用する。
2. 夜間空腹時か就寝前にアルテスネイトなどのアルテミシニン誘導体を服用する。
3. がん細胞の酸化ストレスを高める(ミトコンドリアでの活性酸素の産生量を増やす)目的でジクロロ酢酸ナトリウム、2-デオキシ-D-グルコース、メトホルミンを服用する。
4. がん細胞のグルタチオンを枯渇させるために、スルファサラジンを摂取する。ケトン食の実践はさらに効果を高める。
【がん細胞の酸化ストレスを高めると死にやすくなる】
図:① アルテスネイトはがん細胞内に多く含まれる鉄と反応して、② フリーラジカルを発生させ、③ 酸化傷害を引き起こして、④ フェロトーシスという細胞死を誘導する。⑤ ジクロロ酢酸ナトリウムとメトホルミンはミトコンドリアに作用して活性酸素の産生を高めて、がん細胞の酸化ストレスを亢進する。グルタチオンは抗酸化作用によって酸化傷害とフェロトーシスを阻止する働きを示す。(7)グルタチオンはシステインとグルタミン酸とグリシンの3つのアミノ酸から合成されるが、スルファサラジンはシスチン・トランスポーター(xCT)の働きを阻害することによってグルタチオンの合成を阻害する。(8)グルタチオンの合成にはATPが必要で、酸化型グルタチオンの還元にはNADPHが必要であるが、(9)2-デオキシ-D-グルコース(2-DG)とケトン食はATPとNADPHの産生を阻害することによってグルタチオンの合成と還元を抑制する。アルテステイト、ジクロロ酢酸、メトホルミン、スルファサラジン、2-DG、ケトン食の組合せは、鉄を多く含み解糖系が亢進しているがん細胞に対して選択的にフェロトーシスを誘導して抗腫瘍効果を発揮する。
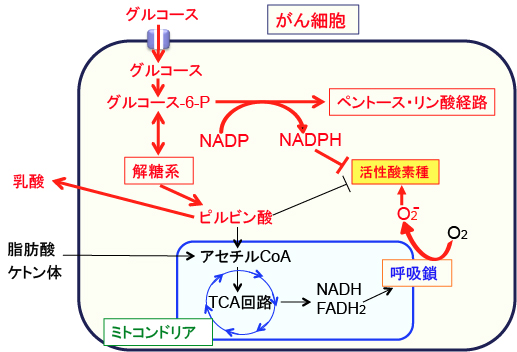
がん細胞のエネルギー産生の最大の特徴である「解糖系の亢進と酸化的リン酸化の抑制」というワールブルグ効果の理由の一つは、「がん細胞が酸化ストレスを高めない」ためです。
がん細胞は細胞内に様々な異常があり、ミトコンドリアでの酸素を使ったエネルギー産生の過程では活性酸素が発生しやすい状態にあります。そのため、酸素が十分に存在する状況でも、ミトコンドリアでの酸素を使ったエネルギー産生を抑制しているのです。
つまり、がん細胞のエネルギー産生は解糖系に依存していますが、ミトコンドリアでの酸化的リン酸化が亢進すると活性酸素の産生量が増え、酸化ストレスが高まると細胞死を起こすことになります。その結果、がん細胞はミトコンドリアで代謝される脂肪酸やケトン体を利用できず、細胞質でグルコースを分解する解糖系が亢進しているのです。
図:上図で赤の矢印と文字はがん細胞で活性化あるいは増えていることを示している。がん細胞ではミトコンドリアの呼吸鎖の異常などによって酸素を使ってATPを産生すると活性酸素の産生量が増える状況にある。そこでがん細胞ではミトコンドリアでのATP産生を抑制して酸化ストレスの増大を防いでいる。そのため、非効率的なエネルギー産生系である解糖系が亢進していて乳酸の産生が増えている。また、ペントース・リン酸経路が亢進し、この経路でできるNADPHは活性酸素の消去に使われる。がん細胞ではミトコンドリアでの代謝を抑えているので、ミトコンドリアで代謝される脂肪酸やケトン体をエネルギー源として利用することができない。(参考:Redox Biology 2: 963-970, 2014年)
ご質問やご相談はメール(info@f-gtc.or.jp)か電話(03-5550-3552)でお問合せ下さい。||
| ホーム|院長紹介|診療のご案内|診療方針|書籍案内|お問い合わせ |
| COPYRIGHT (c) GINZA TOKYO Clinic, All rights reserved. |