酸素ナノバブル水は放射線治療と抗がん剤治療の効き目を高める
【がん細胞は増大するために自前の血管を作っている】
細胞が生きていくためには、酸素や栄養素が絶えず供給されなければなりません。これはがん細胞も同じです。がん細胞は酸素を使わない解糖系でのエネルギー産生が亢進していますが、血液からの栄養と酸素が無いと増殖や生存はできません。
毛細血管から酸素や栄養素が拡散して細胞に届く距離はせいぜい数百μm程度と言われています。つまり、血管ができなければ、がん組織は1~2mm以上の大きさには成長できないのです。酸素や栄養素が届かないと細胞は死ぬからです。
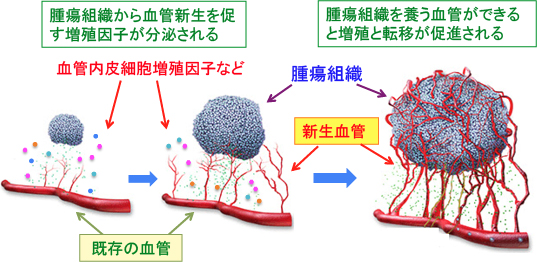
がん組織が1〜2mm程度に成長すると、がん細胞はさらに増殖するために、自らを養う血管を作る必要があります。すなわち、細胞が酸素不足になると、がん細胞自らが、血管内皮細胞増殖因子(VEGF)などの血管を作るために必要な増殖因子を産生して、腫瘍組織を養う血管(新生血管)を作ろうとするのです。これを血管新生(angiogenesis)と言います。
がん細胞が腫瘍血管を新しく作るために、がん細胞は血管内皮細胞増殖因子を分泌して、近くの血管の内皮細胞の増殖を刺激します。さらに周囲の結合組織を分解する酵素を出して増殖した血管内皮細胞をがん組織の方へ導き、血管の内腔を形成する因子を使って新しい血管を作っているのです(図1)。
図1:がん組織は血管が無いと1〜2mm以上には成長できない。そこで、がん細胞は血管内皮細胞増殖因子などの血管新生を促す増殖因子を分泌して血管を作っている。これを「血管新生」と言い、新たにできた血管を「新生血管」という。がん組織を養う血管ができると増殖と転移が促進される。
【がん組織の増殖に血管新生が追いつかないので、低酸素の領域ができる】
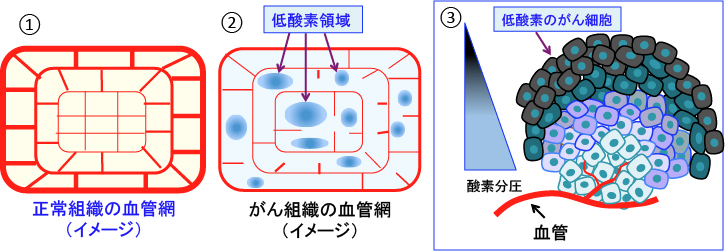
正常組織では、血液の供給が不足して低酸素や低栄養の領域ができないように整然とした血管網が構築されています。 一方、がん組織では、血管網の整備が細胞の増殖に追いつかないので、血液供給が途絶えた低酸素の領域が至る所に存在します。
道路や鉄道のネットワークが整然と構築されておれば、品物の配送や輸送はスムーズに行きます。しかし、災害などで道路や鉄道網が至るところで寸断され、途切れていれば、物流は妨げられます。これと同じように、がん組織では血管網が不完全で至るところで途切れているので、酸素や栄養の不足した領域が多数存在するのです。
前述のように、がん細胞が増殖し、がん組織が大きくなるためには腫瘍組織を養う血管の新生が必要です。がん組織内で新生する血管網は正常組織のように整然としたものではなく、様々な異常を伴い、がん細胞の一部は酸素や栄養素の欠乏に陥っています。
血管内皮細胞の増殖速度はがん細胞の増殖に追いつかないので、不完全な血管網が形成されます。 正常組織のような整然とした血管網ではなく、血管壁構造は不完全(血管周皮細胞や基底膜がない、血管平滑筋が不完全、細胞の受容体が無いなど)で、血管のネットワークも不規則でいびつです。
血管抵抗が高く、血流も滞りやすく、血管自体がもろく、漏れ易い状況です。 リンパ管の発達も不完全で、がん組織では組織液の圧が高くなっています。 酸素と栄養素は血管から拡散によって細胞に到達するので、血管から離れたがん細胞は低酸素と低栄養状態に陥っています(図2)。
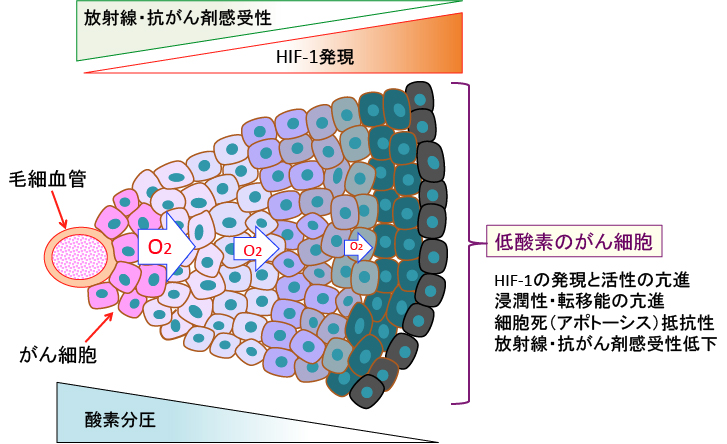
図2:①と②は正常組織とがん組織の血管網のイメージ図を示す。正常組織は整然とした血管網で栄養と酸素供給が行われている(①)。一方、がん組織では、血管網が不完全で、血液が十分に行き渡らないところが多く、至るところで低酸素領域が存在する(②)。がん組織では血管網が不完全であるため、血管から離れた領域のがん細胞は低酸素になっている(③)。
【低酸素になると低酸素誘導因子-1(HIF-1)が活性化される】
生物は外界の酸素濃度を認識する巧みな仕組みを保持しています。酸素濃度が低下すると、生物は低酸素シグナルを活性化し低酸素状態に適応します。 この低酸素応答の中心的分子が低酸素誘導因子-1(Hypoxia inducible factor-1: HIF-1) およびプロリル・ヒドロキシラーゼ(prolyl hydroxylase)と呼ばれるタンパク質です。
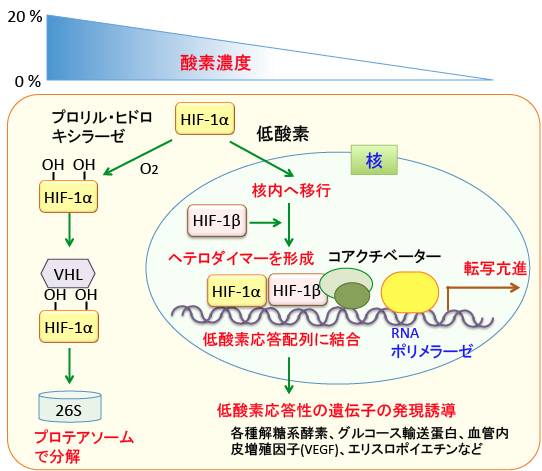
HIF-1は、細胞が酸素不足に陥った際に誘導されてくる転写因子です。αとβの2つのサブユニットからなるヘテロ二量体であり、βサブユニットは定常的に発現して細胞核にいますが、 HIF-1αは細胞質で酸素濃度依存的な分解を受けます。
すなわち、HIF-1αは、正常酸素濃度下では、HIF-1αタンパク質中の2カ所のプロリン残基がプロリル・ヒドロキシラーゼにより水酸化されることによりVHL(von Hippel-Lindau)タンパク質が結合します。 VHLが結合するとHIF-1αのユビキチン化が促進されて26Sプロテアソームで分解されます。したがって、酸素が十分にある状況ではHIF-1は不活性の状態に維持されます。
VHLはフォンヒッペル・リンドウ(von Hippel-Lindau)病の原因遺伝子として発見されています。 フォンヒッペル・リンドウ病は常染色体優性遺伝疾患で、脳・脊髄・網膜の血管芽腫や腎臓がんや褐色細胞腫などの腫瘍が多発します。 VHLたんぱく質が欠損するとHIF-1αが分解されないので、HIF-1転写活性が亢進した状態になり、VEGF(血管内皮細胞増殖因子)のタンパク量が増え、血管の豊富な腫瘍が発生します。
プロリル・ヒドロキシラーゼ(prolyl hydroxylase)は酸素濃度感受性のタンパク質で、酸素濃度が低下するとプロリル・ヒドロキシラーゼの酵素活性が著しく低下します。すると、HIF-1αのプロリン残基の水酸化が起きないので、HIF-1αは分解を受けずに安定化します。 安定化したHIF-1αは核内に移行し、HIF-1βと二量体を形成して低酸素応答配列(Hypoxia Responsive Element)に結合して、低酸素応答に必要な様々な遺伝子の発現を活性化します。
すなわち、HIF-1は各種解糖系酵素、グルコース輸送蛋白、血管内皮細胞増殖因子(VEGF)、造血因子エリスロポイエチンなど、 多くの遺伝子の発現を転写レベルで制御し、細胞から組織・個体にいたる全てのレベルの低酸素適応反応を制御しています(図3)。
図3:酸素濃度が高い状態では、HIF-1αは酸素濃度感受性タンパク質のプロリル・ヒドロキシラーゼによって水酸化され、VHL(von Hippel-Lindau)タンパク質が結合して26Sプロテアソームで分解される。低酸素状態ではプロリル・ヒドロキシラーゼの活性が低下してHIF-1αの分解が阻止されるので、蓄積したHIF-1αは核内に移行してHIF-1βとヘテロダイマー(ヘテロ二量体)を形成して遺伝子の低酸素応答配列に結合し、コアクチベーター(CBP/p300)やRNAポリメラーゼがリクルートされて、低酸素状態の適応に必要な様々な遺伝子の発現を誘導する。
【HIF-1活性が高いがん細胞は浸潤・転移しやすい】
急速に増大するがん組織の中で、がん細胞は常に低酸素、低栄養による細胞死の危険にさらされています。そこで、低酸素や低栄養による細胞死を起こさないようにするメカニズムとしてがん細胞はHIF-1活性を高めています。
これは、HIF-1活性が亢進しているほど、がん細胞は低酸素や低栄養で生存できる(死ににくい)ということを意味しています。
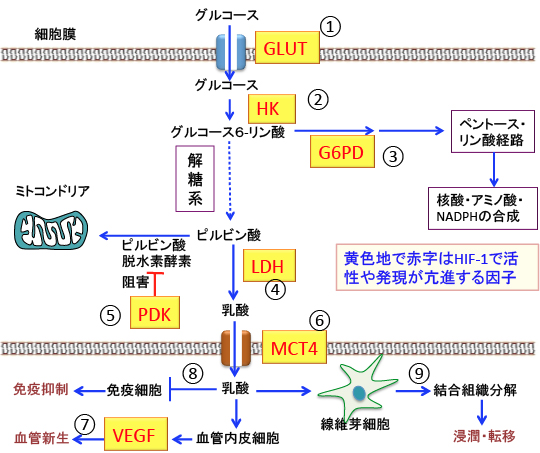
HIF-1はピルビンン酸脱水素酵素キナーゼ(下図のPDK:ピルビン酸脱水素酵素を阻害する)の発現を促進してピルビン酸脱水素酵素(ピルビン酸からアセチルCoAへの変換)の活性を低下させ、さらにピルビン酸から乳酸への嫌気性解糖系に働く乳酸脱水素酵素(LDH)の発現を促進する作用があります。 つまり、HIF-1はピルビン酸からアセチルCoAへの変換を阻害してTCA回路と酸化的リン酸化での代謝を抑制し、嫌気性解糖系(ピルビン酸から乳酸の変換)を亢進します。
さらに、HIF-1は腫瘍特異的なピルビン酸キナーゼ-M2の発現を促進し、解糖系の途中におけるグルコース代謝産物から核酸や脂肪酸やアミノ酸の合成を促進する作用(ペントースリン酸経路の亢進)もあります。
また、HIF-1はがん幹細胞の幹細胞として能力を維持させる作用、上皮-間葉移行や細胞接着因子の遺伝子発現を誘導する作用、VEGFを介する血管新生によりがん細胞の遠隔転移を促進する作用なども知られています。
つまり、HIF-1活性が亢進するとグルコースの取込みと解糖系とペントースリン酸経路が亢進し、ミトコンドリアでの酸化的リン酸化の活性が抑制され、さらに、血管新生が促進され、乳酸の産生が増えると免疫細胞が抑制され、結合組織の分解も促進されて転移や浸潤が起こりやすくなるので、HIF-1活性が高いがんほど予後が悪いと言えます。(図4)
図4:低酸素誘導因子-1(HIF-1)によって発現誘導や活性亢進される因子を図中の赤字(黄色地)で示している。HIF-1はグルコース・トランスポーター(GLUT)の量を増やしてグルコースの取込みを増やす(①)。ヘキソキナーゼ(HK)の量を増やして解糖系を亢進し(②)、グルコース-6-リン酸脱水素酵素(G6PD)を増やしてペントース・リン酸経路を活性化する(③)。乳酸脱水素酵素(LDH)の量を増やしてピルビン酸から乳酸への変換を促進し(④)、ピルビン酸脱水素酵素キナーゼ(PDK)を誘導して(⑤)、ピルビン酸脱水素酵素を阻害して、ピルビン酸からアセチルCoAへの変換を阻害してミトコンドリアでの酸化的リン酸化を抑制する。乳酸を細胞外に排出するモノカルボン酸トランスポーター-4(MCT4)の発現を増やす作用(⑥)、血管新生を促進する血管内皮細胞増殖因子(VEGF)の発現を誘導する作用(⑦)もある。がん細胞から大量に産生される乳酸は免疫細胞の働きを抑制し(⑧)、線維芽細胞を活性化して結合組織を分解してがん細胞の浸潤や転移を促進する(⑨)。このような作用によって、HIF-1の活性亢進は、がん細胞の解糖系を亢進し、ミトコンドリアでの酸化的リン酸化は抑制され、血管新生や免疫抑制や結合組織の分解などによって、増殖や浸潤や転移が促進される。
【低酸素のがん細胞はHIF-1活性が亢進してがん治療に抵抗性になる】
酸素と栄養素は血管から拡散によって細胞に到達するので、血管から離れたがん細胞は低酸素と低栄養状態に陥っています。 酸素や栄養素が不足すれば、がん細胞の増殖が低下し、死滅することが期待できるので、それは治療にメリットがあるように考えることもできます。つまり、がん組織の兵糧攻めという戦略では、腫瘍血管からの栄養と酸素の供給を阻止することを目標にしています。
しかし実際は、がん組織の低酸素化は低酸素誘導性因子-1(HIF-1)を活性化し、低酸素状態に適応したがん細胞は、より浸潤性と転移性を高める事が明らかになっています。細胞死(アポトーシス)に対しても抵抗性になります。
酸素を使わない解糖系での代謝が亢進すると、がん組織はさらに酸性化します。このがん組織の酸性化は、血管新生を誘導し、浸潤や転移を促進し、生体の免疫細胞からの攻撃を阻害します。
つまり、がん組織における低酸素という微小環境は、がん細胞の悪性度を高め、治療効果を弱めることにつながります。
1950年代に、がん組織の低酸素が放射線治療の効果を弱めることが報告されています。 低酸素はヒト遺伝子の1〜2%ほどの遺伝子の発現を調節しており、これはHIF-1が行っています。HIF-1は低酸素で活性化される転写因子です。 がん組織の低酸素状態はHIF-1の発現と活性を亢進して、がん細胞はアポトーシスに抵抗性になり、放射線治療や抗がん剤治療に抵抗性になります。がん組織の低酸素状態を改善すると、放射線治療や抗がん剤治療の効果が高くなることが明らかになっています(図5)。
図5:酸素や栄養素が拡散で到達できるのは数百μm程度。がん組織は血管網が不完全であるため、毛細血管から離れたがん細胞は低酸素に陥っている。低酸素のがん細胞では低酸素誘導因子-1(HIF-1)の発現と活性が亢進している。HIF-1の活性亢進はがん細胞の浸潤性・転移能を亢進し、細胞死(アポトーシス)に抵抗性になり、放射線治療や抗がん剤治療に対する感受性が低下する。
【有酸素運動でがん組織の酸素供給を増やすとがん治療の効果が高まる】
有酸素運動は、がん組織の低酸素を除去する方法の一つです。
運動は様々な健康作用を持ちます。鬱状態を軽減し、免疫系を亢進します。 がんと運動の関係においては、発がん予防や再発予防やがんサバイバーの症状の改善などが中心に研究されていますが、がん治療における効果についてはあまり検討されていません。 しかし、研究結果をまとめると、 「運動はがん組織の血液循環を良くし、低酸素状態を改善することによって治療効果を高める」というのが現在のコンセンサスのようです。
つまり、がん患者さんが有酸素運動を積極的に行うことは、いろんなメカニズムで、がん治療や再発予防に役立つと言えます。以下のような報告があります。Effects of exercise training on tumor hypoxia and vascular function in the rodent preclinical orthotopic prostate cancer model.(齧歯類における前臨床試験としての同所性前立腺がんモデルにおける腫瘍低酸素および血管機能に対する運動訓練の効果)J Appl Physiol (1985). 2013 Dec;115(12):1846-54.
この論文では、ラットの前立腺がんの実験モデルを使って、トレッドミルによる運動をさせた群と運動をさせなかった群で比較しています。 その結果、運動はがん組織の微小環境における血液循環を良くして低酸素状態を改善し、その結果がん細胞の浸潤性や悪性度が低下し、生存率を良くすることを報告しています。
がん細胞は酸素を嫌う嫌気的な生き物で、酸素が少ない方が生存に有利な細胞です。したがって、運動によってがん組織の血液循環と酸素供給を増やすことは、がん細胞の増殖抑制に有効と言えます。
また、抗がん剤治療に高圧酸素療法を併用して抗腫瘍効果を高める治療法も報告されています。 がん組織の低酸素化を改善して酸素が十分に行き渡ると、抗がん剤や放射線治療の効き目を高めることがあきらかになっています。
サリドマイドや血管内皮細胞増殖因子(VEGF)阻害剤は血管新生を阻害する作用によって抗腫瘍効果を発揮すると一般には考えられていますが、がん組織内の血管(腫瘍血管)を正常化(normalization)して、がん組織内の血液循環を良くして、抗がん剤や放射線治療の効果を高めるというメカニズムも指摘されています。
前述のように、固形がんでは、腫瘍細胞の増殖に血管の増生や構築が間に合わなく、異常な血管が作られ、不十分な血管網を構築し、がん組織の至る所で低酸素状態に陥っています。 低酸素になると、がん細胞は様々な適応応答を発動し、その結果、抗がん剤や放射線による細胞死(アポトーシス)に抵抗性になります。
また、放射線治療は活性酸素を産生してがん細胞を死滅させますが、この効果は酸素が無い状態では阻害されます。 抗がん剤の多くも、最終的に細胞死を引き起こすときに活性酸素が関与しており、酸素が乏しい条件では、細胞死が起こりにくいことが明らかになっています。
また、「がん細胞のミトコンドリアを活性化して活性酸素の産生を高めて、がん細胞を自滅させる」というがんの酸化治療においても、低酸素の条件ではがん細胞のミトコンドリアでの活性酸素の発生が低下するので、がん細胞を死滅させることができません。
免疫療法も、酸素の無い場所では、リンパ球などの免疫細胞も働けません。
つまり、多くのがん治療において、がん組織の低酸素状態は、治療効果を妨げていることになるのです。 したがって、がん組織の酸素濃度を高めることががん治療の効果を高める重要な因子になります。
がん組織の酸素分圧を高める治療法として、高圧酸素療法、酸素の吸入、オゾン療法、過酸化水素点滴、酸素含有キャリア懸濁液の注射などが試みられています。 しかし、これらの治療法の有効性は十分に証明されておらず、また副作用が問題なものもあります。
がん組織の低酸素を改善する方法として、酸素ナノバブル水の効果が注目されています。
ナノバブル(nanobubble)というのは、直径がナノメートル(nm)レベルの泡(bubbule)のことです。 1nm(ナノメートル)は1mm(ミリメートル)の100万分の1の長さです。1mmの1000分の1が1μm(マイクロメートル)で、1μmの1000分の1が1nm(ナノメートル)です。 つまり、1μm以下のナノメートルのレベルの超微細な酸素の泡が充満した水が「酸素ナノバブル水」ということになります。
【酸素ナノバブル水はがん組織の低酸素を改善してHIF-1の発現を低下させる】
酸素ナノバブル水ががん組織の低酸素を改善してHIF-1の発現を低下させることが複数の研究グループから報告されています。 以下の論文は英国のオックスフォード大学の医用生体工学研究所(Oxford Institute of Biomedical Engineering)の研究グループからの報告です。
Reducing Tumour Hypoxia via Oral Administration of Oxygen Nanobubbles(ナノバブル酸素の経口投与による腫瘍低酸素の軽減)PLoS One. 2016; 11(12): e0168088.
【要旨】
低酸素症は固形腫瘍に対する治療効果を阻害する重要な要因であることが示されている。しかしながら、低酸素症を減少させるための既存の方法は有効性が限られており、有害な副作用が問題なものもある。
この研究の目的は、界面活性剤で安定化された酸素ナノバブル水の経口投与によって、腫瘍の低酸素状態を低下させる可能性を調べることである。
実験は、オスのSCIDマウス(重度複合免疫不全マウス)にヒト膵臓がん細胞(BxPc-3細胞)を移植するマウス異種移植片腫瘍モデルで行った。
100μLの酸素飽和水、酸素ナノバブル水またはアルゴンナノバブル水の単回投与を経口より投与した。 それぞれの水を投与して30分後に腫瘍を切除して(1群3匹づつ)、腫瘍組織内の低酸素誘導因子-1α(HIF-1α)のmRNAとタンパク質の発現レベルをリアルタイム定量的ポリメラーゼ連鎖反応およびウエスタンブロット分析によって測定した。
酸素飽和水もアルゴンナノバブル水も、転写レベル(mRNAレベル)でHIF1α発現に統計的に有意な変化を生じなかった。 対照的に、酸素ナノバブル水の投与を受けたマウスの腫瘍組織では、HIF1αの転写(mRNA)および翻訳(タンパク質)の発現量は、それぞれ75%および25%の減少が見られた(p <0.001)。 このHIF-1α発現の減少レベルは、放射線治療と化学療法の治療効果を改善できるレベルであることが以前の研究において示されている。 加えて、酸素ナノバブル水投与群では、腫瘍組織内の血管内皮細胞増殖因子(VEGF)の発現レベルが有意に減少し、arrest-defective protein 1 homolog A (ARD1A)の発現は増加を示した。この論文で重要なのは、「酸素ナノバブル水の投与を受けたマウスの腫瘍組織では、HIF1αの転写(mRNA)および翻訳(タンパク質)の発現量が減少した」ということです。 この実験では、腫瘍組織の酸素分圧が上がったことを評価する指標として「HIF-1αの発現レベル」を使っています。
前述のように(図3参照)、酸素濃度が高い状態では、HIF-1αは酸素濃度感受性タンパク質のプロリル・ヒドロキシラーゼによって水酸化され、VHL(von Hippel-Lindau)タンパク質が結合して26Sプロテアソームで分解されます。 つまり、酸素ナノバブル水を投与して、がん組織の酸素分圧が高くなり、低酸素が改善されると、HIF-1αは急速に分解されます。したがって、HIF-1αのタンパク質が減少したことは、がん組織の酸素分圧が上昇したことを意味します。
血管内皮細胞増殖因子(VEGF)はHIF-1によって転写が促進されるので、VEGFはmRNAもタンパク質も減少します。 arrest-defective protein 1 homolog A (ARD1A) はアセチル化酵素で、酸素分圧が正常な場合に、 HIF-1α のリジン532(Lys532)をアセチル化して、Von Hippel Lindau (VHL)タンパク質の結合を促進し、HIF-1αのユビキチン化とプロテオソームでの分解を促進します。
【日本の企業が世界最小レベルの酸素ナノバブル水を作成している】
マイクロバブルやナノバブルは粒径が小さいほどより安定性が高いことが知られています。 日本のシグマテクノロジー社の「マイクロナノバブル発生装置ΣPM-5」は直径2nmの酸素ナノバブルを、200京個/ml(2,0 x 1018/ml) の高濃度で作成できます。
この世界最小レベルの酸素ナノバブル水を使った実験結果が発表されています。 米国のウィスコンシン大学と群馬大学の研究グループからの論文です。Development of single nanometer-sized ultrafine oxygen bubbles to overcome the hypoxia-induced resistance to radiation therapy via the suppression of hypoxia-inducible factor-1α(低酸素誘導因子-1αの抑制を介する放射線治療に対する低酸素誘導性の抵抗性を克服する10nm以下の超微細酸素バブルの開発) Int J Oncol. 2018 Mar; 52(3): 679–686.
【要旨】
放射線療法は様々な重度の副作用をもたらすが、その中には放射線耐性の発現も含まれる。この研究の目的は、低酸素誘導因子1-α(HIF-1α)サブユニットの抑制を介してがん細胞株における放射線耐性を克服するための酸素ナノバブル水の使用を検証することである。
低温透過型電子顕微鏡(cryo-transmission electron microscope)を用いて水中での酸素ナノバブルの大きさと濃度を調べた。ナノバブルのサイズは2〜3nmの範囲であり、ナノバブルの濃度は2×1018個/ mlであった。
EBC-1肺がん細胞およびMDA-MB-231乳がん細胞を用いて、in vitroの実験系で、正常酸素状態および低酸素状態での、酸素ナノバブル水と放射線の作用を検討した。
酸素ナノバブルを含まない培養液中で培養したがん細胞に比べて、酸素ナノバブル含有培養液中で増殖させたがん細胞は、低酸素で誘導されるHIF-1αの発現の明らかな抑制を示した。
低酸素条件下では、EBC-1およびMDA-MB231細胞は、酸素正常細胞下で培養された細胞と比較して、放射線に対する耐性を示した。 通常の培養液で培養したがん細胞と比較して、酸素ナノバブルを添加した培養液で培養したがん細胞では、2、6、10および14Gy(グレイ)の放射線照射に対する低酸素誘導性の放射線耐性を有意に抑制した。
重要なことに、酸素ナノバブル培地の使用は、正常酸素状態のがん細胞株または非がん細胞株BEAS-2Bの生存率および放射線感受性に影響しなかった。
このように新たに作られた一桁台のナノメートル範囲の酸素ナノバブル水は、HIF-1αの抑制を介したメカニズムで、放射線に対する低酸素誘導性のがん細胞の耐性を克服するために使用されうる有望な作用を持っていることが示唆された。この論文では、培養細胞を使ったin vitroの実験だけですので、生体内の腫瘍の酸素濃度を高めるかどうかは不明です。 しかし、オックスフォード大学の研究では、酸素ナノバブル水がマウスの移植腫瘍の実験モデルで、HIF-1αの発現低下を示しており、酸素ナノバブル水の摂取ががん組織の低酸素状態を改善する改善する可能性が示唆されています。
酸素ナノバブル水はナノバブルの大きさが小さいほど安定で、組織内浸透も良いと言えます。 したがって、この「極微小」「高濃度」の酸素ナノバブル水をがん治療に応用する価値はあると思います。この論文に使用されたのと同じシグマテクノロジー社の「マイクロナノバブル発生装置ΣPM-5」で作成した酸素ナノバブル水を、銀座東京クリニックで販売することになりました。
10L(9000円)、20L(15000円)です(代金は消費税、送料込み)。 1日に700ml程度を摂取すると、10Lが約半月分、20Lが約1ヶ月分になります。
ご注文はサイトからお願いします(酸素ナノバブル水のご注文サイト)。
ご質問などはメール(info@f-gtc.or.jp)か電話(03-5550-3552)でご連絡下さい。注意:
酸素ナノバブルの効果は人間のがん患者さんを対象にした臨床試験で証明されたものではありませんし、医薬品でもありません。 しかし、「がん組織の低酸素状態を改善する」ことが、がんの治療に極めて有用であることは、多くの基礎研究で明らかになっています。 私が行っている「ミトコンドリアを活性化して活性酸素の産生を高めてがん細胞を自滅させる」という治療法(酸化治療)は、がん組織が低酸素状態では効果が低下します。
がん組織の低酸素状態を改善する方法として高圧酸素療法や酸素吸入のような方法もありますが、より簡便で安全な方法として酸素ナノバブル水に注目した次第です。 副作用は全くなく、費用もそれほど高価でないので、試してみる価値はあります。◎ 酸素ナノバブルについてはこちらへ:
◎「がん組織の低酸素状態を改善すると放射線治療と抗がん剤治療の効果が高まる」理由についてはこちらへ:
低酸素誘導因子-1(HIF-1)とがんについて:
がん細胞においては、様々なメカニズムでHIF-1活性が恒常的に亢進しています。したがって、腫瘍組織の酸素濃度を高めただけでは、HIF-1活性を抑制することは無理です。他の方法も併用する必要があります。
【がん細胞では低酸素でなくてもHIF-1が恒常的に活性化している】
がん細胞の代謝の特徴は、酸素が十分に利用できる状況でも、酸素を使わない解糖系が亢進し、ミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)が抑制されていることです。つまり、酸素があっても、あたかも低酸素のような代謝を行っているわけです。 これをワールブルグ効果と言います。
このような代謝の特徴の根本的なメカニズムは、がん細胞では酸素濃度とは関係なく、恒常的にHIF-1が活性化しているためです。つまり、がん細胞では恒常的に低酸素シグナルがオンになっているということです。
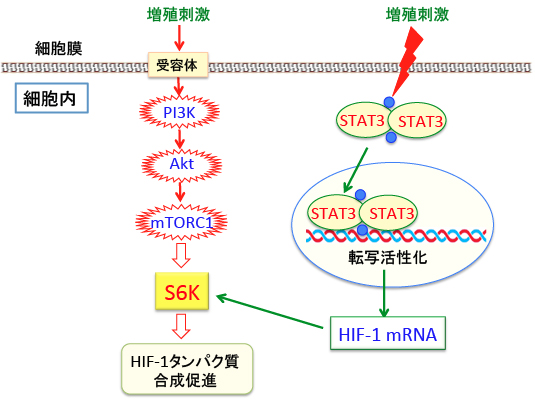
その理由は、がん細胞で活性化されているmTORC1やSTAT3がHIF-1の産生を促進するからです。
がん細胞の増殖シグナル伝達系であるPI-3キナーゼ/Akt/mTORC1シグナル伝達系においてmTORC1はHIF-1のタンパク質の産生(mRNAからタンパク質の翻訳)を促進します。
また、増殖因子やサイトカインで活性化されるSTAT3という転写因子はHIF-1遺伝子の転写を亢進します。 mTORC1(哺乳類ラパマイシン標的タンパク質複合体1)はリボソームの生合成を促進するS6Kをリン酸化して活性化する作用によって蛋白質合成を促進し、HIF-1タンパク質の産生を増やします。
一方、STAT(signal transducer and activator of transcription;シグナル伝達兼転写活性化因子)は、様々な増殖因子やサイトカインを中心とする細胞外からの刺激によって活性化されたJAKなどのチロシンキナーゼによってリン酸化を受けると2量体を形成し、核内に移行してさまざまな遺伝子の発現を誘導します。
STAT転写ファミリーには7種類が存在しますが、特にSTAT3はほとんどすべての固形がんで活性化されており、細胞のがん化に重要な働きをすることが分かっています。 STAT3はHIF-1の遺伝子発現(転写)を促進することが知られています。
つまり、がん細胞で活性が亢進しているmTORC1とSTAT3はHIF-1タンパク質の産生量を相乗的に高めることが報告されています(下図)。 HIF-1αタンパク質の発現量が増えても、HIF-1αの分解に関与するプロリルヒドロキシラーゼ(prolyl hydroxylase)やVHL(von Hippel-Lindau)タンパク質が正常に働けばHIF-1の活性亢進を抑制できますが、がん細胞ではプロリルヒドロキシラーゼやVHLの発現低下や遺伝子変異によってHIF-1αの分解過程に異常を起こしていることも多いことが報告されています。
図:増殖刺激や遺伝子変異などによってがん細胞で恒常的に活性が亢進しているSTAT3(シグナル伝達兼転写活性化因子)はHIF-1遺伝子の転写(mRNAの産生)を促進し、mTORC1はリボソームの生合成を促進するS6Kを活性化してHIF-1タンパク質の合成を促進する。
結節性硬化症(tuberous sclerosis)は、皮膚の血管線維腫や腎臓の血管筋脂肪腫や肺のリンパ脈管平滑筋腫症などの腫瘍性病変や、脳の機能障害(てんかん、知的障害、自閉症など)を合併する疾患です。 その原因遺伝子がTSC1とTSC2です。TSC1は9番染色体に存在し、TSC2は16番染色体に存在します。TSCはtuberous sclerosis complex(結節性硬化症複合体)の略です。 遺伝子がコードするタンパクは、TSC1がハマルチン(hamartin)、TSC2がチュベリン(tuberin)で、両因子は互いに結合して複合体を形成し、mTORC1の上流に位置して、mTORC1の活性を抑制する働きがあります。
したがって、TSC1/TSC2の遺伝子変異などによってハマルチン-チュベリン複合体の機能が障害されるとmTORC1が活性化され、HIF-1が活性化され、血管内皮細胞増殖因子(VEGF)の発現が誘導され、血管増生が高度な腫瘍が発生します。
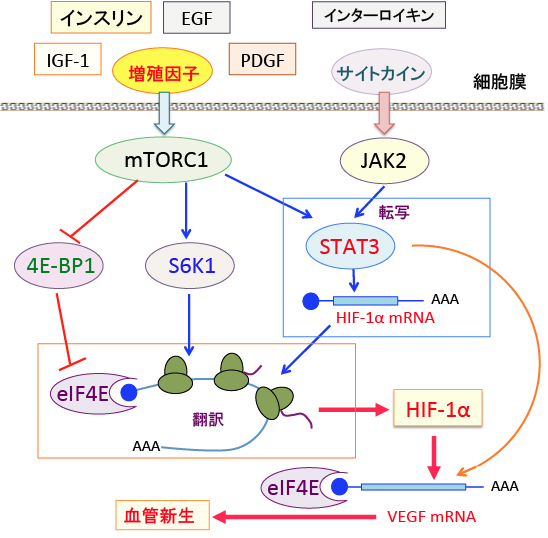
mTORC1によるHIF-1αの発現亢進は3つのメカニズムによって引き起こされます。
① mTORC1はSTAT3 (Signal Tranducer and Activator of Transcription-3:シグナル伝達兼転写活性化因子-3) の転写を亢進し、STAT3がHIF-1αの遺伝子転写を促進する
② mTORC1はリボソームの生合成を促進するS6Kをリン酸化して活性化する作用によって蛋白質合成を促進し、HIF-1αタンパク質の産生を増やす。
③ 真核生物翻訳開始因子4E(eIF4E)はmRNAのたんぱく質への翻訳を開始させる。リン酸化されていない4E-BP1(eIF4E結合たんぱく質1)はeIF4Eに結合することによってたんぱく質の翻訳を阻止する。mTORC1が4E-BP1をリン酸化すると、eIF4Eの機能が回復するので、たんぱく質合成が促進される。
図:インスリンやインスリン様成長因子-1(IGF-1)や上皮成長因子(EGF)や血小板由来増殖因子(PDGF)などの増殖因子や、インターロイキンやサイトカイン類がmTORC1とJAK2を活性化し、STAT3を相乗的に活性化する。STAT3は低酸素誘導因子-1α(HIF-1α)の転写を亢進する。mTORC1は翻訳を阻害する4E-BP1の発現を阻害し、たんぱく合成を促進するS6K1の発現を亢進することによってHIF-1αのたんぱく質量を増やす。STAT3とHIF-1αはVEGF(血管内皮増殖因子)の遺伝子発現を亢進し、mTORC1はeIF4Eを介してVEGFのたんぱく質合成を亢進する。その結果、血管新生が亢進する。(参考:Oncoscience. 2015; 2(11): 913–914.)
mTORC1はSer727をリン酸化することによってSTAT3の転写活性を高めます。さらに、様々なサイトカインや増殖因子は、受容体チロシンキナーゼのJAK2を介する機序で、STAT3を活性化します。
多くのがん細胞で、JAK2/STAT3シグナル伝達系とmTORC1シグナル伝達系の両方の活性が亢進しており、この異常はHIF-1αの活性亢進に収束しています。 がん細胞の増殖はmTORC1とHIFとVEGFに高度に依存的です。 mTORC1とVEGFをターゲットにした治療薬はありますが、HIFを直接ターゲットにした薬はまだありません。 血管新生阻害に関しては、mTORC1阻害剤とVEGF受容体阻害剤が使用されています。 HIFのすぐ上流に位置するSTAT3の阻害はHIF阻害のターゲットとして有用です。
血管の豊富な腫瘍の治療薬としてSTAT3阻害剤は有効性が期待できます。 STAT3阻害剤としてはオーラノフィン、ジインドリルメタン、セレコキシブが使用できます。 HIF-1活性の阻害にはラパマイシン、メラトニン、ベザフィブラートなどが使用できます。 ジインドリルメタン、シリマリン、ジクロロ酢酸もHIF-1活性の阻害作用が報告されています。 さらにAMPKを活性化するメトホルミン、DHA/EPA、ケトン食などの組合せも有効です。 VEGFやIL-6の発現を抑制するサリドマイドも有効です。
ラパマイシン(mTORC1阻害)、オーラノフィン(IL-6/STAT3阻害)、セレコキシブ(COX-2阻害+IL-6/STAT3阻害)、ジインドリルメタン(STAT3阻害+HIF-1阻害)、ベザフィブラート(PPARの汎アゴニスト)、フェノフィブラート(PPARα選択的アゴニスト)、メラトニン、DHA/EPA、サリドマイドなどの組合せは、がん細胞におけるワールブルグ効果を引き起こす最大の因子であるmTORC1と低酸素誘導因子-1(HIF-1)の発現と活性を阻害することによって、がん細胞の増殖を抑制できると思います。
このような複数のメカニズムを組み合せて、がん細胞のmTORC1/HIF-1/VEGF系を抑えるとがん細胞の増殖の抑制に有効と思われます。 魚の脂に多く含まれるドコサヘキサンエン酸(DHA)とエイコサペンタンエン酸(EPA)はmTORC1/HIF-1シグナルの抑制、抗炎症作用、抗酸化作用など多様なメカニズムで抗老化、がん予防、寿命延長の効果が期待できます。 サプリメントや脂ののった魚で1日数グラムのDHA/EPAを摂取することは有用だと思います。マグロの大トロは100グラムで5グラム程度のDHA/EPAを摂取できます。他の脂ののった魚も100グラム当たり1〜4グラム程度のDHA/EPAを摂取できます。 AMPKの活性化はがん予防や抗老化に有効なので、運動やカロリー制限にDHA/EPAの多い食事は抗老化とがん予防に効果が期待できます。これらに加えて、酸素ナノバブル水を日頃から摂取すると、さらに抗腫瘍効果を高めることができます。
当院では多数の補完・代替療法を実践しています。それぞれの治療法の根拠や有効性を示すために、それぞれのページで詳しく解説しています。しかし、がんの種類や進行度や治療の状況によって最適な治療法は異なります。それぞれの治療法を理解し、自分に合った治療法を選択することは、患者さんには困難だと思います。 現在の病状や治療の状況をメール(info@f-gtc.or.jp)か電話(03-5550-3552)かファックス(03-3541-7577)でお知らせいただければ、全て院長(福田一典)がお答えしています。ご来院いただければ、詳しくご説明いたします。